|
 |
 |
| |
|
|

| wenn die hitzewelle sinkt |
| Schmerzforschung
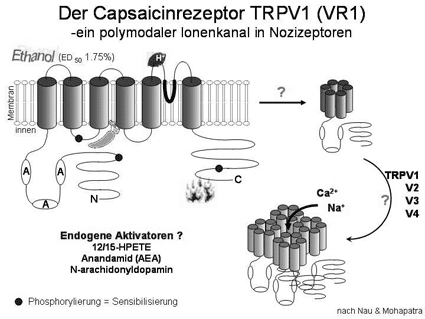
bezieht Impulse aus dem Paprika-Inhaltstoff Capsaicin Wenn die Hitzeschwelle sinkt Eigentlich wird die Zentrale falsch informiert. "Verbrennungsgefahr!", besagt die Meldung. "Hier ist es unerträglich heiß!" Tatsächlich herrscht nicht mehr als normale Körperwärme, vielleicht sogar nur Raumtemperatur. Um Fehlalarm handelt es sich trotzdem nicht. Zwar bringt keine heiße Herdplatte oder offene Flamme den Organismus in Gefahr; dennoch ist er bedroht, und das Gehirn interpretiert das Signal korrekt als generelle Warnung. An der Universität Erlangen-Nürnberg verfolgen drei Arbeitsgruppen im Detail, wie Hitzeempfindlichkeit in der Schmerzwahrnehmung zum Vielzweck-Werkzeug wird. Ein Pharmakologe aus Ungarn hatte als Erster den Weg dazu gewiesen. Hundert Jahre alt wäre Professor Nikolaus Jancso im April 2003 geworden. Auf dem Schreibtisch von Professor Peter Reeh vom Institut für Physiologie und Experimentelle Pathophysiologie liegt seither die Medaille, in die das Profil des Begründers der Capsaicin-Forschung eingeprägt ist. Capsaicin verleiht der Paprika ihre "typisch ungarisches" Feuer. Jancso hatte den natürlichen Wirkstoff, der auch die Schärfe von Peperoni oder Chili-Schoten ausmacht, isoliert und damit experimentiert. "Er war verblüfft über dessen Selektivität", berichtet Prof. Reeh. "Ausschließlich Nozizeptoren, schmerzleitende Nervenfasern, werden davon erregt. Sie degenerieren sogar, wenn sie der Substanz länger ausgesetzt werden, während andere Nerven völlig unberührt bleiben." Der Gedanke lag nahe, dass es einen eigenen Rezeptor geben müsse, ein Molekül an der Oberfläche der Nervenzellen, in das sich ein Capsaicin-Molekül einfügt wie ein dreidimensionales Puzzleteilchen. Der Rezeptor wurde gefunden und führte zur nächsten Schlussfolgerung: dass körpereigene Botenstoffe vorhanden sein müssten, die eigentlichen Partner, die den Nervenreiz auslösen sollen. Moderne molekularbiologische Methoden, die es erlauben, schnell und in großer Zahl identische Protein-Moleküle nach einem Muster herzustellen, halfen Ende der 90er Jahre, passende Substanzen zu entdecken. Für das Entstehen von Schmerz spielen sie jedoch keine große Rolle. Ein anderer Auslöser stellte sich als entscheidend heraus: die Temperatur. "Der Capsaicin-Rezeptor wurde als hitzeaktivierter Ionenkanal entlarvt", erklärt Prof. Reeh. Sobald die Wärme über die Schmerzgrenze steigt, öffnet sich der Kanal und lässt positiv geladene Ionen passieren, was die Nervenzelle veranlasst, ihr Warnsignal abzugeben. Dass in der Haut solche hitzeempfindlichen Zellen zu finden sind, ist leicht als sinnvoll zu begreifen. Wer mit dem Feuer spielt, zuckt unwillkürlich zurück. Aber welchen Nutzen haben Nozizeptoren in Brustfell und Hirnhaut, im Dickdarm und in der Bauchspeicheldrüse, wenn sie auf 46° Celsius reagieren, einem Punkt auf der Messlatte für Körpertemperaturen, an dem Mensch und Tier längst tot sind? In der Überkapazität liegt ein Hinweis auf die Reichweite des Wahrnehmungsmechanismus. Sie bildet eine Art Pufferzone, denn bei jeder Art von Entzündung sinkt die Reaktionsschwelle auf niedrigere Temperaturen, eventuell unter die Körpertemperatur. Dann meldet die Nervenzelle "Hitze", und das Nervensystem übersetzt die Botschaft in "Schmerz". Unter anderen Vorzeichen haben die meisten Menschen selbst schon erfahren, wie diese Kommunikationskette funktioniert: Entzündungsschmerz lässt sich durch Kühlung lindern, allerdings nur vorübergehend.
Die Alarmanlage des Körpers für Entzündungen hat sich inzwischen als recht vielseitig erwiesen. Capsaicin-Rezeptoren besitzen Regionen, die auf Hitze, Säure, Schärfe oder Alkohol reagieren (vgl. Abbildung). Die Sensibilitätsschwelle wird jeweils durch Phosphor-Bindung gesenkt. Dafür verantwortlich ist, wie Prof. Reeh es nennt, eine "inflammatorische Suppe", ein Cocktail von Mediatoren, also Botenstoffen, die bei Entzündungen ausgeschüttet werden. Von den beteiligten Substanzen und ihrem Ineinandergreifen ist mittlerweile manches bekannt, anderes noch ungeklärt. Darüber hinaus existieren vier Arten solcher Ionenkanäle, die auf verschiedenen Genen "festgeschrieben" sind an der Schmerzentstehung auf unterschiedliche Weise beteiligt sein können. Auf dem scheinbar eng gefassten Arbeitsfeld gibt es für die drei Forscherteams in Erlangen reichlich zu tun.
“Zugepropfter”
Ionenkanal Eine andere Möglichkeit wäre es, erst am Ende der Kette anzusetzen und den Ionen den Durchgang zu versperren, als ob der Kanal mit einem Pfropfen verschlossen würde. In ähnlicher Weise funktioniert eine Lokalanästhesie. Doch auf diesem Weg gibt es ebenfalls Hindernisse, etwa die Gefahr, ein oder mehrere Organe auf Dauer zu schädigen. Die bis zu 12 Jahre, die den Arbeitsgruppen in einem Sonderforschungsbereich an Zeit gegeben werden, sind bei der Langwierigkeit der Untersuchungen voll ausgefüllt. Sie werden in der Hoffnung investiert, dass es eines Tages gelingt, dafür zu sorgen, dass es schmerzempfindlichen Nervenzellen nicht mehr unnötig heiß wird. Weitere Informationen Prof. Dr. Peter
Reeh Mediendienst Forschung-Aktuell Nr. 666 vom 21.07.03 |
||||||||
| zentrale universitätsverwaltung pressestelle --- zuletzt aktualisiert am 05.08.2003 | ||||||